Une nouvelle étude éclaire la dynamique des transmissions zoonotiques du mpox en République centrafricaine (RCA)
Une nouvelle étude éclaire la dynamique des transmissions zoonotiques du mpox en République centrafricaine (RCA)
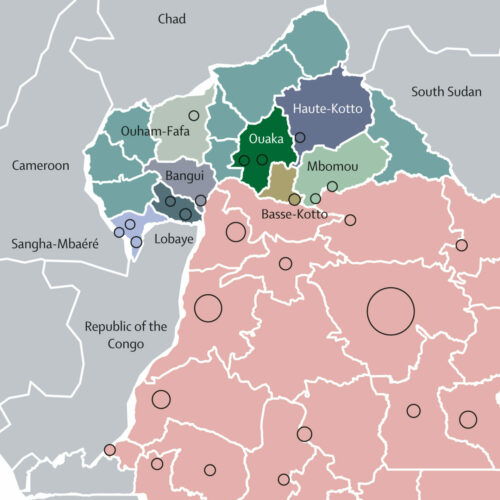
Localisation géographique des génomes du mpox analysés. La plupart des génomes prélevés en République centrafricaine se trouvent dans les préfectures du sud, près de la frontière avec la République démocratique du Congo (indiquées en rose). Image adapté d’article original dans Lancet Microbiology
Une étude publiée dans The Lancet Microbe retrouve que la majorité des cas humains de mpox diagnostiqués en République centrafricaine (RCA) provient de transmissions multiples de l’animal vers l’homme, et non de chaînes de transmission interhumaine.
Cette recherche a été menée par l’Institut Pasteur de Bangui (IPB) avec le soutien d’AFROSCREEN.
Comprendre la diversité du mpox en Afrique
Le mpox, maladie virale zoonotique, se divise en deux grands groupes génétiques :
- Clade 1, qui circule principalement en Afrique centrale
- Clade 2, présent en Afrique de l’Ouest
Depuis 2022, on a assisté à l’émergence de nouveaux lignages présentant une transmission interhumaine efficace, justifiant une classification plus fine.
On distingue :
- Clade 1a, principalement zoonotique, présent dans plusieurs pays d’Afrique centrale
- Clade 1b, associé à une transmission inter humaine, identifié en 2024 dans le Sud-Kivu, République démocratique du Congo (RDC)
- Clade 2a, qui persiste en Afrique de l’Ouest,
- Clade 2b, à l’origine de l’épidémie mondiale qui a débuté au Nigéria en 2022.
Principaux résultats
Bien que la RCA figure parmi les pays les plus touchés par le mpox, l’ampleur et l’impact des transmissions zoonotiques y restaient mal connus. Grâce au soutien d’AFROSCREEN, les équipes de l’IPB ont collecté des données épidémiologiques et séquencé 46 échantillons prélevés entre 2022 et 2024.
Sur ces 46 séquençages, 39 génomes étaient complets à plus de 90 % et 2 à plus de 70 %, offrant une vision inédite de la diversité du virus dans le pays.
Tous les génomes analysés appartenaient au clade 1a, sans signe de mutation du gène APOBEC3 associée une transmission interhumaine accrue. Ces résultats indiquent que l’épidémie de mpox en RCA est principalement liée à des chaînes de transmission inter humaines sur des temps courts (« bouffées épidémiques »), en particulier dans les zones rurales. Ce type de transmission est similaire à celui observé en RDC.
À la capitale Bangui, une flambée urbaine a été signalée le 20 juillet 2024. L’analyse des séquences a révélé des génomes génétiquement distincts les uns des autres, suggérant la diffusion indépendante de plusieurs sous types de virus. Cette circulation est probablement en lien avec les mouvements de population entre zones rurales et urbaines ainsi qu’aux activités de commerce de viande de brousse.
Pourquoi ces résultats sont importants
La multiplication des cas de transmission animal-humain augmente le risque d’adaptation du virus jusqu’à une transmission soutenue inter humaine. Dans ce contexte, il est donc essentiel de renforcer la surveillance épidémiologique, notamment dans les zones rurales, afin de détecter les nouveaux foyers de façon précoce.
Au-delà de cette surveillance, les chercheurs soulignent la nécessité de mieux explorer les réservoirs animaux pour mieux réduire les risques de transmission. Cette approche One Health, souligne la pertinence d’étudier les cas humains, mais également la faune, les écosystèmes et certaines pratiques comme la chasse et le commerce de viande de brousse.
Référence :
Gourinat A, Gnimadi A, Pani N, et al. Monkeypox virus clade Ia epidemiology in the Central African Republic, 2022–24. The Lancet Microbe, 2025.
Lire l’article ici
Localisation géographique des génomes du mpox analysés. La plupart des génomes prélevés en République centrafricaine se trouvent dans les préfectures du sud, près de la frontière avec la République démocratique du Congo (indiquées en rose). Image adapté d’article original dans Lancet Microbiology
Une étude publiée dans The Lancet Microbe retrouve que la majorité des cas humains de mpox diagnostiqués en République centrafricaine (RCA) provient de transmissions multiples de l’animal vers l’homme, et non de chaînes de transmission interhumaine.
Cette recherche a été menée par l’Institut Pasteur de Bangui (IPB) avec le soutien d’AFROSCREEN.
Comprendre la diversité du mpox en Afrique
Le mpox, maladie virale zoonotique, se divise en deux grands groupes génétiques :
- Clade 1, qui circule principalement en Afrique centrale
- Clade 2, présent en Afrique de l’Ouest
Depuis 2022, on a assisté à l’émergence de nouveaux lignages présentant une transmission interhumaine efficace, justifiant une classification plus fine.
On distingue :
- Clade 1a, principalement zoonotique, présent dans plusieurs pays d’Afrique centrale
- Clade 1b, associé à une transmission inter humaine, identifié en 2024 dans le Sud-Kivu, République démocratique du Congo (RDC)
- Clade 2a, qui persiste en Afrique de l’Ouest,
- Clade 2b, à l’origine de l’épidémie mondiale qui a débuté au Nigéria en 2022.
Principaux résultats
Bien que la RCA figure parmi les pays les plus touchés par le mpox, l’ampleur et l’impact des transmissions zoonotiques y restaient mal connus. Grâce au soutien d’AFROSCREEN, les équipes de l’IPB ont collecté des données épidémiologiques et séquencé 46 échantillons prélevés entre 2022 et 2024.
Sur ces 46 séquençages, 39 génomes étaient complets à plus de 90 % et 2 à plus de 70 %, offrant une vision inédite de la diversité du virus dans le pays.
Tous les génomes analysés appartenaient au clade 1a, sans signe de mutation du gène APOBEC3 associée une transmission interhumaine accrue. Ces résultats indiquent que l’épidémie de mpox en RCA est principalement liée à des chaînes de transmission inter humaines sur des temps courts (« bouffées épidémiques »), en particulier dans les zones rurales. Ce type de transmission est similaire à celui observé en RDC.
À la capitale Bangui, une flambée urbaine a été signalée le 20 juillet 2024. L’analyse des séquences a révélé des génomes génétiquement distincts les uns des autres, suggérant la diffusion indépendante de plusieurs sous types de virus. Cette circulation est probablement en lien avec les mouvements de population entre zones rurales et urbaines ainsi qu’aux activités de commerce de viande de brousse.
Pourquoi ces résultats sont importants
La multiplication des cas de transmission animal-humain augmente le risque d’adaptation du virus jusqu’à une transmission soutenue inter humaine. Dans ce contexte, il est donc essentiel de renforcer la surveillance épidémiologique, notamment dans les zones rurales, afin de détecter les nouveaux foyers de façon précoce.
Au-delà de cette surveillance, les chercheurs soulignent la nécessité de mieux explorer les réservoirs animaux pour mieux réduire les risques de transmission. Cette approche One Health, souligne la pertinence d’étudier les cas humains, mais également la faune, les écosystèmes et certaines pratiques comme la chasse et le commerce de viande de brousse.
Référence :
Gourinat A, Gnimadi A, Pani N, et al. Monkeypox virus clade Ia epidemiology in the Central African Republic, 2022–24. The Lancet Microbe, 2025.
Lire l’article ici